Gases Perfeitos
Verificam-se a existência de vários gases na natureza (oxigênio, hélio, hidrogênio,...) os gases reais. Por possuírem características moleculares diferentes, muitas vezes possuem comportamentos diferentes. Em determinadas condições eles comportam-se de maneira semelhante.
Neste estudo, serão estudadas apenas as três grandezas macroscópicas que caracterizam um sistema gasoso: pressão, volume e temperatura. Também será usado um modelo de gás, o gás perfeito.
O gás perfeito é um gás hipotético, que não existe, mas é um modelo que segue as leis de Boyle, Charles, Gay-Lussac e Clapeyron.
O modelo de gás perfeito deve seguir algumas características:
- é constituído por moléculas monoatômicas;
- não há choque entre as moléculas do gás;
- só há colisões entre as moléculas e as paredes do recipiente;
- os choques com as paredes do recipiente são perfeitamente elásticos;
- não sofre condensação;
Um gás real exibe propriedades muito similares ao dos gases perfeitos, particularmente no limite de baixas pressões e altas temperaturas.
Grandezas variáveis de um gás
A pressão, o volume a temperatura são as grandezas que definem o estado de um gás.
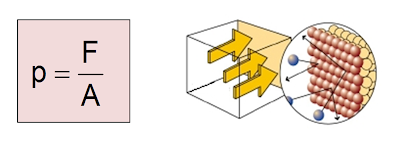
Pressão
A pressão é definida como a razão entre a força exercida em uma determinada área.
A pressão que um gás exerce nas paredes do recipiente que o contém é devido a inúmeras colisões entre as moléculas que o compõem e as paredes do recipiente.
Unidades de pressão
1 Pa = 1 N m−2
1 bar = 1 · 105 Pa
1 mmHg = 133,32 Pa
1 atm = 1, 01 · 105 Pa
Volume
O gás não possui forma e volume definidos. O volume que um gás possui é igual ao volume do recipiente ocupado por ele.
1 m³ = 10³ L
Temperatura
Mede o estado de agitação das moléculas do corpo. No estudo dos gases perfeitos a temperatura deve estar na escala Kelvin onde:
T = qc + 273
Equação de Clapeyron
O físico francês Benoit Paul Émile Clapeyron estabeleceu uma equação que relaciona as três grandezas físicas variáveis do gás (pressão, volume e temperatura) e o número de mols, desde que o gás esteja submetido a baixa pressão e alta temperatura.
p.V = n.R.T
Onde:
p = pressão do gás
V= volume do gás
R = a constante universal dos gases:
R = 8,31 Joule/ (mol.K)
R = 0,082 atm . L / (mol . K)
n = número de mol do gás:
T = temperatura do gás.
Exercício resolvido
Um cilindro metálico de 41 litros contém argônio (massa de um mol = 40 g) sob pressão de 90 atm à temperatura de 27 °C. Qual a massa de argônio no interior desse cilindro?
Resolução:
Retirando os dados fornecidos no texto, tem-se:
V = 41 L
M = 40 g
p = 90 atm
T = 27 °C = 300 K
Primeiro determina-se o número de mols do argônio:
p . V = n . R . T
90 . 41 = n . 0,082 . 300
3690 = 24,6 n
n = 150 mols
Agora se calcula a massa do gás:
n = m/M Þ 150 = m/40
m = 6000 g = 6 kg
Leis dos gases perfeitos
Algumas transformações gasosas podem ocorrer com o número de mols constante. Entre as transformações, existem três particulares importantes que possuem leis específicas.
Lei de Gay-Lussac – Transformação isobárica
Esta lei rege as transformações isobáricas, em que, iso significa igual e bárico refere-se à pressão, isto é, a transformação ocorre sempre à pressão constante.
Pela equação de Clapeyron, p.V = n.R.T ® como n, R e p são constantes, tem-se:
V = (n.R/p) . T
V = cte . T
Assim, num gás perfeito, o volume é diretamente proporcional à temperatura, ou seja, se o volume do gás duplicar, a temperatura também duplica.
Gráficos da transformação isobárica V x T
No gráfico anterior, várias curvas isobáricas são apresentadas para um mesmo gás, porém em cada caso tem-se uma pressão diferente: p1 > p2 > p3.
Lei de Charles – transformação isocórica
Esta lei rege as transformações isocóricas, em que, iso significa igual e córica é relativo a volume, isto é, a transformação ocorre sempre à volume constante.
Pela equação de Clapeyron, p.V = n.R.T ® como n, R e V são constantes, tem-se:
p = (n.R/V) . T
p = cte . T
Assim, num gás perfeito, a pressão é diretamente proporcional à temperatura, ou seja, se a pressão do gás duplicar, a temperatura também duplica.
A representação gráfica da transformação isocórica é:
Várias retas isocóricas são representadas para o mesmo gás, mas com diferentes volumes de forma que V1 > V2 > V3.
Lei de Boyle-Mariote - Transformação isotérmica
Esta lei rege as transformações isotérmicas, em que, iso significa igual e térmica é relativo a temperatura, isto é, a transformação ocorre sempre à temperatura constante.
Pela equação de Clapeyron, p.V = n.R.T ® como n, R e T são constantes, tem-se:
p . V = cte
Assim, num gás perfeito, a pressão é inversamente proporcional ao volume, ou seja, se a pressão do gás duplicar, o volume é reduzido à metade.
A representação gráfica da transformação isotérmica é:
Várias retas isotermas são representadas para o mesmo gás, mas com diferentes temperaturas de forma que T1 < T2 < T3.
Exercícios resolvidos
1. 15 litros de uma determinada massa gasosa encontram-se a uma pressão de 8 atm e à temperatura de 30oC. Ao sofrer uma expansão isotérmica, seu volume passa a 20 litros . Qual será a nova pressão?
Resolução:
p1 = 8 atm
V1 = 15 L
T1 = 30 °C
p2 = ?
V2 = 20 L
Sabendo que a transformação foi isotérmica, tem-se:
p1 . V1 = p2 . V2
8 . 15 = p2 . 20
p2 = 6 atm
Resposta: A nova pressão do gás será 6 atm.
2. Uma certa massa gasosa ideal sofre uma transformação a volume constante, conhecida como Lei de Charles. Sua pressão inicial é de uma atmosfera e sua temperatura passa de 400K para 500K. Determine a nova pressão da massa gasosa.
Resolução:
p1 = 1 atm
T1 = 400 K
p2 = ?
T2 = 500 K
Sabendo que a transformação foi isocórica, tem-se:
Resposta: A nova pressão do gás será 1,25 atm.
Lei Geral dos Gases Perfeitos
Uma massa de gás perfeito pode ter algumas de suas grandezas alteradas. Nessa transformação, pode-se relacionar os dois estados distintos do gás pela equação de Clapeyron.
Igualando as duas expressões, obtém-se a Equação Geral dos Gases Perfeitos:
Exercícios resolvidos
1. Um gás perfeito é mantido em um cilindro fechado por um pistão. Em um estado A, as suas variáveis são: pA = 2,0 atm; VA = 0,90 litros ; TA = 27ºC. Em outro estado B, a temperatura é TB = 127ºC e a pressão é pB = 1,5 atm. Nessas condições, o volume VB, em litros, deve ser:
a) 0,90
b) 1,2
c) 1,6
d) 2,0
Resolução:
Dados fornecidos:
pA = 2 atm
VA = 0,90 L
TA = 27 °C = 300 K
pB = 1,5 atm
VB = ?
TB = 1,27 °C = 400 K
Resposta: Alternativa C
2. Certa massa de gás perfeito tem volume Vo, pressão po e temperatura igual a 327 oC. Qual será a temperatura do gás, em °C, quando o volume for Vo/2 e a pressão 4po/3 ?
Resolução:
Dados fornecidos:
pA = po
VA = Vo
TA = 327 °C = 600 K
pB = 4po/3
VB = Vo/2
TB = ?
Mistura de Gases Perfeitos
Considere dois recipientes contendo gases que não reagem quimicamente entre si quando são misturados. No recipiente A, encontram-se nA mols do gás A ocupando um volume VA, sob pressão pA numa temperatura TA. No recipiente B, encontram-se nB mols do gás B ocupando um volume VB, sob pressão pB numa temperatura TB.
Ao misturar os dois gases perfeitos, pode-se afirmar que o número de mols total da associação é a soma do número de mols do gás A com o número de mols do gás B.
Exercício resolvido
Reúnem-se, num recipiente de capacidade igual a 10 litros , 5 litros de hidrogênio à pressão de 20 atm e 10 litros de oxigênio à pressão de 10 atm em equilíbrio térmico. Qual a pressão final da mistura, em atm sabendo que a temperatura manteve-se constante?
Resolução:
ph = 20 atm
Vh = 5 L
pox = 10 atm
Vox = 10 L
Tox = ?
VM = 10 L
pM = 20 atm